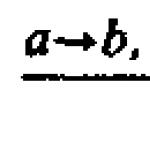Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения .
Как известно в биоэнергетике живых организмов имеют значение два основных момента:
- а) химическая энергия запасается путём образования АТФ, сопряжённого с экзергоническими катаболическими реакциями окисления органических субстратов;
- б) химическая энергия утилизируется путём расщепления АТФ, сопряжённого с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии .
Встаёт вопрос, почему молекула АТФ соответствует своей центральной роли в биоэнергетике. Для его разрешения рассмотрим структуру АТФ Структура АТФ - (при рН 7,0 тетразаряд аниона) .
АТФ представляет собой термодинамически нестойкое соединение. Нестабильность АТФ определяется, во - первых, электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы, однако сильнее всего связи - Р - О - Р, и во - вторых, конкретным резонансом. В соответствии с последним фактором существует конкуренция между атомами фосфора за неподелённые подвижные электроны атома кислорода, расположенного между ними, поскольку на каждом атоме фосфора имеется частичный положительный заряд в следствии значительного электронаицепторного влияния групп Р=О и Р - О-. Таким образом, возможность существования АТФ определяется наличием достаточного количества химической энергии в молекуле, позволяющей компенсировать эти физико - химические напряжения. В молекуле АТФ имеется две фосфоангидридных (пирофосфатных) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН 7,0 и 37 о С).
АТФ+Н 2 О = АДФ + Н 3 РО 4 G0I = - 31,0 КДж/моль.
АДФ+Н 2 О = АМФ +Н 3 РО 4 G0I = - 31,9 КДж/моль.
Одной из центральных проблем биоэнергетики является биосинтез АТФ, который в живой природе происходит путём Фосфорилирование АДФ.
Фосфорилирование АДФ является эндергоническим процессом и требует источника энергии. Как отмечалось ранее, в природе преобладает два таких источника энергии - это солнечная энергия и химическая энергия восстановленных органических соединений. Зелёные растения и некоторые микроорганизмы способны трансформировать энергию, поглощённых квантов света в химическую энергию, которая расходуется на фосфорилирование АДФ в световой стадии фотосинтеза. Этот процесс регенерации АТФ получил название фотосинтетического фосфорилирования. Трансформация энергии окисления органических соединений в макроэнергетические связи АТФ в аэробных условиях происходит преимущественно путём окислительного фосфорилирования. Свободная энергия, необходимая для образования АТФ, генерируется в дыхательной окислительной цепи митаходрий.
Известен ещё один тип синтеза АТФ, получивший название субстратного фосфорилирования. В отличии от окислительного фосфорилирования, сопряжённого с переносом электронов, донором активированной фосфорильной группой (- РО3 Н2), необходимой для регенерации АТФ, являются интермедианты процессов гликолиза и цикла трикарбоновых кислот. Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений: 1,3 - дифосфоглицерата (гликолиз), сукцинил - КоА (цикл трикарбоновых кислот), которые при участии соответствующих ферментов способны фолирировать АДФ и образовывать АТФ. Трансформация энергии на уровне субстрата является единственным путём синтеза АТФ в анаэробных организмах. Этот процесс синтеза АТФ позволяет поддерживать интенсивную работу скелетных мышц в периоды кислородного голодания. Следует помнить, что он является единственным путём синтеза АТФ в зрелых эритроцитах не имеющих митохондрий.
Особо важную роль в биоэнергетике клетки играет адениловый нуклеотид, и которому присоединены два остатка фосфорной кислоты. Такой вещество называется аденозинтрифосфорной кислотой (АТФ). В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфорита:
АТФ= АДФ+Ф+Е,
где Ф - фермент, Е - освобождающая энергия. В этой реакции образуется аденозинфосфорная кислота (АДФ) - остаток молекулы АТФ и органический фосфат. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производство тепла, нервных импульсов, свечений (например, улюминисцентных бактерий), то есть для всех процессов жизнедеятельности .
АТФ - универсальный биологический аккумулятор энергии. Световая энергия, заключенная в потребляемой пище, запасается в молекулы АТФ.
Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20 - 30 сокращений. При усиленной, но кратковременной работе мышцы работают исключительно за счёт расщепления содержащейся в них АТФ. После окончания работы человек усиленно дышит - в этот период происходит расщепление углеводов и других веществ (происходит накопление энергии) и запас АТФ в клетках восстанавливается.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
- · Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
- · Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
- · АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата - вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах .
Какую функцию выполняют липиды в клеточных мембранах?
4.2. Обмен веществ и энергии
В каких реакциях обмена исходным веществом для синтеза углеводов является вода?
Энергию какого типа потребляют гетеротрофные живые организмы?
Энергию какого типа потребляют автотрофные организмы?
В какую фазу фотосинтеза происходит синтез АТФ?
Какое вещество служит источником кислорода во время фотосинтеза?
^ Почему гетеротрофные организмы сами не могут создавать органические вещества?
Почему жиры являются наиболее энергетическими веществами?
Что служит матрицей для синтеза и-РНК?
В каких реакциях обмена углекислый газ является исходным веществом для синтеза углеводов?
В чем проявляется сходство фотосинтеза и энергетического обмена веществ?
^ В чем сходство и различие процессов фотосинтеза и хемосинтеза?
^ В каких реакциях обмена веществ вода является конечным продуктом?
В каких реакциях обмена веществ осуществляется связь между ядром, ЭПС, рибосомами, митохондриями?
В чем сходство биосинтеза белка и фотосинтеза?
Что происходит в световую фазу фотосинтеза?
^ Какие основные процессы происходят в темновую фазу фотосинтеза?
^ Какова роль нуклеиновых кислот в биосинтезе белка?
^ В чем заключается биологический смысл окислительного фосфорилирования?
^ В чем заключается сходство и различие автотрофного питания у фото- и хемосинтезирующих бактерий?
Различие: фототрофные бактерии для синтеза глюкозы используют энергию света, а хемотрофные – энергию окисления неорганических веществ.
^ Какова взаимосвязь между пластическим и энергетическим обменом веществ? Аргументируйте свой ответ.
^ Почему реакции биосинтеза белка называют матричными?
^ В чем проявляется взаимосвязь энергетического обмена и биосинтеза белка?
Определите последовательность нуклеотидов на и-РНК, антикодоны т-РНК и аминокислотную последовательность соответствующего фрагмента молекулы белка (используя таблицу генетического кода), если фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ГТГЦЦГТЦАААА.
^ К каким последствиям приведет снижение активности ферментов, участвующих в кислородном этапе энергетического обмена животных?
Одна из цепей ДНК имеет последовательность нуклеотидов: ЦАТ- ГГЦ- ТГТ – ТЦЦ – ГТЦ… Объясните, как изменится структура молекулы белка, если произойдет удвоение четвертого триплета нуклеотидов в цепи ДНК?
В биосинтезе полипептида участвуют молекулы т-РНК с антикодонами УГА, АУГ, АГУ, ГГЦ, ААУ. Определите нуклеотидную последовательность участка каждой цепи молекулы ДНК, который несет информацию о синтезируемом полипептиде, и число нуклеотидов, содержащих аденин (А), гуанин (Г), тимин (Т), цитозин (Ц) в двухцепочечной молекуле ДНК. Ответ поясните.
2) ДНК: 1-ая цепь: ТГА – АТГ – АГТ – ГГЦ – ААТ
2-ая цепь: АЦТ – ТАЦ –ТЦА –ЦЦГ - ТТА
3) количество нуклеотидов: А – 9 (30%), Т – 9 (30%), так как А=Т; Г -6 (20%), Ц – 6 (20%), так как Г=Ц.
^ В каких случаях изменение последовательности нуклеотидов ДНК не влияет на структуру и функции соответствующего белка?
В биосинтезе белка участвовали т-РНК с антикодонами: УУА, ГГЦ, ЦГЦ, АУУ, ЦГУ. Определите нуклеотидную последовательность участка каждой цепи молекулы ДНК, который несет информацию о синтезируемом полипептиде, и число нуклеотидов, содержащих аденин, гуанин, тимин, цитозин в двухцепочечной молекуле ДНК.
т-РНК: УУА, ГГЦ, ЦГЦ, АУУ, ЦГУ
и-РНК: ААУ-ЦЦГ-ГЦГ-УАА-ГЦА
1 цепь ДНК: ТТА-ГГЦ-ЦГЦ-АТТ-ЦГТ
2 цепь ДНК: ААТ-ЦЦГ-ГЦГ-ТАА-ГЦА.
В молекуле ДНК А=Т= 7, число Г=Ц= 8.
Общая масса всех молекул ДНК в 46 соматических хромосомах одной соматической клетки человека составляет 6х10 -9 мг. Определите, чему равна масса всех молекул ДНК в сперматозоиде и в соматической клетке перед началом деления и после его окончания. Ответ поясните.
В пробирку поместили рибосомы из разных клеток, весь набор аминокислот и одинаковые молекулы и-РНК и т-РНК, создали все условия для синтеза белка. Почему в пробирке будет синтезироваться один вид белка на разных рибосомах?
В процессе трансляции участвовало 30 молекул т-РНК. Определите число аминокислот, входящих в состав синтезируемого белка, а также число триплетов и нуклеотидов в гене, который кодирует этот белок.
В одной молекуле ДНК нуклеотиды с тимином (Т) составляют 24% от общего числа нуклеотидов. Определите количество (в %) нуклеотидов с гуанином (Г), аденином (А), цитозином (Ц) в молекуле ДНК и объясните полученные результаты.
^ Дана цепь ДНК: ЦТААТГТААЦЦА. Определите:
Б) Количество (в%) различных видов нуклеотидов в этом гене (в двух цепях)
В) Длину этого гена
Г) Длину белка
ОТВЕТ: А) 1-ая цепь ДНК: ЦТА-АТГ-ТАА-ЦЦА-
2-ая цепь ДНК: ГАТ-ТАЦ-АТТ- ГГТ-
^ И-РНК: ЦУА-АУГ-УАА-ЦЦА
По таблице генетического кода определяем аминокислоты:
Аминокислоты: лей- мет- тир - про
Б) Количество А=8; Т=8; Г=4; Ц=4. Все количество = 24 = 100%.
А=Т= 8 (8х100%) : 24 = 33, 3%
Г=Ц=4 (4х100%) : 24= 16,6%
В) Длина гена: 12х 0,34 = 4,04 нм (0,34нм – длина 1 нуклеотида)
Г) Длина белка: 4 кодона х 0,3нм = 1,2 нм (0,3нм – длина 1 ам/к-ты.)
Определите:последовательность нуклеотидов на и-РНК, антикодоны соответствующих т-РНК и аминокислотную последовательность соответствующего фрагмента молекулы белка (используя таблицу генетического кода),
^ ОТВЕТ: ГТГ-ТАТ-ГГА-АГТ - ДНК
ЦАЦ-АУА-ЦЦУ-УЦА – и-РНК
ГУГ; УАУ; ГГА; АГУ - антикодоны т-РНК
Аминокислоты: Гис-иле-про-сер
4.3. Размножение и развитие организмов
Общая масса всех молекул ДНК в 46 хромосомах одной соматической клетки человека составляет около 6х10 -9 мг. Определите, чему равна масса всех молекул ДНК в сперматозоиде и в соматической клетке перед началом деления и после его окончания. Ответ поясните.
^ В чем заключается биологический смысл митоза?
^ В чем заключается биологический смысл мейоза?
^ Что называется зиготой?
В чем заключается сходства и различия яйцеклеток лягушки и человека?
^ Каково значение интерфазы в жизни клетки?
^ Каково значение двойного оплодотворения у цветковых растений?
^ В чем заключаются преимущества и недостатки бесполого и полового размножений?
^ Чем отличаются клетки печени осла от клеток печени лошади?
Почему для сохранения ценных гетерозиготных особей используют вегетативное размножение?
^ Опишите строение и функции яйцеклеток животных.
^ Назовите зародышевый листок зародыша позвоночного животного, обозначенный на рисунке цифрой 1. Какие типы тканей, органы или части органов формируются из него?
^ Какие процессы происходят в ядре клетки в интерфазе?
^ Раскройте механизмы, обеспечивающие постоянство числа и формы хромосом в клетках организмов из поколения в поколение?
^ Объясните, почему при половом размножении появляется более разнообразное потомство, чем при вегетативном .
^ 4.4. Основы селекции
Чем характеризуется явление полиплоидии?
Чем характеризуется явление гетерозиса?
Каково значение закона гомологических рядов в наследственной изменчивости Н.И.Вавилова?
^ С какой целью в селекции растений применяют скрещивание особей разных сортов?
^ Как можно сохранить у растений сочетания полезных признаков, полученные от скрещивания двух сортов?
^ С какой целью проводят в селекции близкородственное скрещивание. Какие отрицательные последствия оно имеет?
^ Для чего проводят межлинейную гибридизацию в селекции растений?
Почему эффект гетерозиса проявляется только в первом поколении?
^ Почему методы полиплоидии и искусственного мутагенеза, применяемые в селекции растений, не применимы в селекции животных?
^ Что такое искусственный мутагенез и для чего его применяют?
^ 4.5. Основы экологии
Почему у разных животных разная плодовитость?
Для всех организмов действует закономерность: чем больше вероятность гибели потомства, тем больше плодовитость.
^ Каковы основные факторы-ограничители для растений, для животных, микроорганизмов?
Для микроорганизмов: нехватка пищевых ресурсов, неблагоприятные условия (температурный, водный, газовый режим, химические вещества (антибиотики для паразитов)
^ В каких отраслях народного хозяйства используются бактерии?
^ Почему существуют редкие и исчезающие виды, если любой организм способен к беспредельному росту численности?
^ В чем сущность закона ограничивающего фактора?
^ Школьники для озеленения территории взяли молодые ели из леса, а не из просеки. Посадили все правильно, но потом хвоя побурела и осыпалась. Почему?
^ Почему на поверхности водоемов обитают растения с зеленой окраской, а на морских глубинах – красной?
^ Какие приспособления для экономного расходования воды имеют животные суши?
^ Можно ли назвать почвой смесь песка, воды, неорганических и органических веществ?
^ Почему наземные млекопитающие имеют ушные раковины, а у водных и почвенных- их нет или редуцированы?
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
- Введение
- 1.1 Химические свойства АТФ
- 1.2 Физические свойства АТФ
- 2.1
- 3.1 Роль в клетке
- 3.2 Роль в работе ферментов
- 3.4 Другие функции АТФ
- Заключение
- Библиографический список
Перечень условных обозначений
АТФ - аденозинтрифосфат
АДФ - аденозиндифосфат
АМФ - аденозинмонофосфат
РНК - рибонуклеиновая кислота
ДНК - дезоксирибонуклеиновая кислота
НАД - никотинамидадениндинуклеотид
ПВК - пировиноградная кислота
Г-6-Ф - фосфоглюкозоизомераза
Ф-6-Ф - фруктоза-6-фосфат
ТПФ - тиаминпирофосфат
ФАД - фениладениндинуклеотид
Фн - неограниченный фосфат
G - энтропия
РНР - рибонуклеотидредуктаза
Введение
Основным источником энергии для всех живых существ, населяющих нашу планету, служит энергия солнечного света, которую используют непосредственно только клетки зеленых растений, водорослей, зеленых и пурпурных бактерий. В этих клетках из углекислого газа и воды в процессе фотосинтеза образуются органические вещества (углеводы, жиры, белки, нуклеиновые кислоты и др.). Поедая растения, животные получают органические вещества в готовом виде. Энергия, запасенная в этих веществах, переходит вместе с ними в клетки гетеротрофных организмов.
В клетках животных организмов энергия органических соединений при их окислении превращается в энергию АТФ. (Углекислый газ и вода, выделяющиеся при этом, вновь используются автотрофными организмами для процессов фотосинтеза.) За счет энергии АТФ осуществляются все процессы жизнедеятельности: биосинтез органических соединений, движение, рост, деление клеток и др.
Тема по образованию и использованию АТФ в организме давно не нова, но редко, где встретишь полное рассмотрение того и другого в одном источнике и еще реже анализ сразу обоих этих процессов и в разных организмах.
В связи с этим, актуальностью нашей работы стало тщательное изучение образования и использования АТФ в живых организмах, т.к. данная тема не изучается на должном уровне в научно-популярной литературе.
Целью нашей работы было:
· изучение механизмов образования и путей использования АТФ в организме животных и человека.
Перед нами были поставлены задачи:
· Изучить химическую природу и свойства АТФ;
· Проанализировать пути образования АТФ в живых организмах;
· Рассмотреть пути использования АТФ в живых организмах;
· Рассмотреть значение АТФ для организма человека и животных.
Глава 1. Химическая природа и свойства АТФ
1.1 Химические свойства АТФ
Аденозинтрифосфат - нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. АТФ был открыт в 1929 году Карлом Ломанном, а в1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке .
Систематическое наименование АТФ:
9-в-D- рибофуранозиладенин-5"-трифосфат , или
9-в-D- рибофуранозил-6-амино-пурин-5"-трифосфат .
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание - аденин - соединяется в-N-гликозидной связью с 1"-углеродом рибозы. К 5"-углероду рибозы последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: б, в и г .
По строению АТФ сходна с адениновым нуклеотидом, входящим в состав РНК, только вместо одной фосфорной кислоты в состав АТФ входят три остатка фосфорной кислоты. Клетки не в состоянии содержать кислоты в заметных количествах, а только их соли. Поэтому фосфорная кислота входит в АТФ в виде остатка (вместо ОН-группы кислоты имеется отрицательно заряженный атом кислорода).
Под действием ферментов молекула АТФ легко подвергается гидролизу, то есть присоединяет молекулу воды и расщепляется с образованием аденозиндифосфорной кислоты (АДФ):
АТФ + Н2О АДФ + Н3РО4.
Отщепление еще одного остатка фосфорной кислоты превращает АДФ в аденозинмонофосфорную кислоту АМФ:
АДФ + Н2О АMФ + Н3РО4.
Эти реакции обратимы, то есть АМФ может переходить в АДФ и далее в АТФ, аккумулируя энергию. Разрушение обычной пептидной связи высвобождает лишь 12 кДж/моль энергии. А связи, которыми присоединены остатки фосфорной кислоты, высокоэнергетичны (их еще называют макроэргическими): при разрушении каждой из них выделяется 40 кДж/моль энергии. Поэтому АТФ играет в клетках центральную роль универсального биологического аккумулятора энергии. Молекулы АТФ синтезируются в митохондриях и хлоропластах (лишь незначительное их количество синтезируется в цитоплазме), а затем поступают к различным органоидам клетки, обеспечивая энергией все процессы жизнедеятельности.
За счет энергии АТФ происходит деление клетки, активный перенос веществ через клеточные мембраны, поддержание мембранного электрического потенциала в процессе передачи нервных импульсов, а также биосинтез высокомолекулярных соединений и физическая работа.
При усиленной нагрузке (например, в беге на короткие дистанции) мышцы работают исключительно за счет запаса АТФ. В клетках мышц этого запаса хватает на несколько десятков сокращений, а дальше количество АТФ должно восполняться. Синтез АТФ из АДФ и АМФ происходит за счет энергии, выделяющейся при расщеплении углеводов, липидов и других веществ. На выполнение умственной работы также затрачивается большое количество АТФ. По этой причине людям умственного труда требуется повышенное количество глюкозы, расщепление которой обеспечивает синтез АТФ .
1.2 Физические свойства АТФ
АТФ состоит из аденозина и рибозы - и трех фосфатных групп. ATФ хорошо растворим в воде и довольно устойчивы в растворах при рН 6.8-7.4, но быстро гидролизуется в экстремальных рН. Следовательно, АТФ лучше всего хранить в безводных солях.
АТФ является неустойчивой молекулой. В небуферизованной воде, он гидролизуется до АДФ и фосфата. Это потому, что прочность связей между фосфатными группами в АТФ меньше, чем прочность водородных связей (гидратации облигации), между своей продукции (АДФ + фосфат), и воду. Таким образом, если АТФ и АДФ находятся в химическом равновесии в воде, почти все АТФ будет в конечном счете превращается в AДФ. Система, которая далека от равновесия содержит свободную энергию Гиббса, и способен делать работу. Живые клетки поддерживают соотношение АТФ в АДФ в точке десять порядков от равновесия, при концентрации АТФ в тысячу раз выше, чем концентрация AДФ. Это смещение от положения равновесия означает, что гидролиз АТФ в клетке выпускает большое количество свободной энергии .
Две высокоэнергетические фосфатные связи (те, которые соединяют соседние фосфаты) в молекулы АТФ несут ответственность за высокое содержание энергии этой молекулы. Энергия, запасенная в АТФ может быть освобождена от гидролиза. Расположенный дальний от сахара рибозы, г-фосфатная группа имеет более высокую энергию гидролиза, чем любой б - или в-фосфат. Связи, образованные после гидролиза или фосфорилирования остатка АТФ - ниже по энергии, чем других связей АТФ. Во время фермент-катализируемого гидролиза АТФ или АТФ фосфорилирования, имеющиеся свободная энергия может быть использована на живые системы, чтобы сделать работу .
Любая нестабильная система потенциально реактивных молекул потенциально может служить способом хранения свободной энергии, если клетки сохранили свою концентрацию далеко от точки равновесия реакции. Однако, как и в случае с большинством полимерных биомолекул, разбивка РНК, ДНК и АТФ в простые мономеры обусловлена как выделение энергии и энтропии, увеличение соображения, как в стандартной концентрации, а также тех концентрациях, в которых встречается в клетке .
Стандартное количество энергии, выделяющейся в результате гидролиза АТФ может быть рассчитана по изменениям в энергии, не связанных с природными (стандартные) условия, то исправление биологической концентрации. Чистое изменение в тепловой энергии (энтальпии) при стандартной температуре и давлении разложения АТФ в АДФ и неорганических фосфатов - 20,5 кДж / моль, с изменением свободной энергии на 3,4 кДж / моль. Энергия выпускается путем расщепления фосфата или пирофосфата от АТФ на государственный стандарт 1 М являются:
АТФ + H 2 O > АДФ + P я ДG ? = - 30,5 кДж / моль (-7,3 ккал / моль)
АТФ + H 2 O > AMP + PP я ДG ? = - 45,6 кДж / моль (-10,9 ккал / моль)
Эти значения могут быть использованы для расчета изменения энергии в физиологических условиях и клеточных АТФ / АДФ. Тем не менее, более представительная значимость, называемая энергетическим зарядом, чаще работает. Значения приведены для свободной энергии Гиббса. Эти реакции зависят от ряда факторов, включая общую ионную силу и присутствие щелочно-земельных металлов, такие как ионы Mg 2 + и Ca 2 + . В обычных условиях, ДG составляет около - 57 кДж / моль (-14 ккал / моль) .
белок биологический аккумулятор энергия
Глава 2. Пути образования АТФ
В организме АТФ синтезируется путём фосфорилирования АДФ:
АДФ + H 3 PO 4 + энергия > АТФ + H 2 O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование (используя энергию окисляющихся веществ). Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена .
В организме АТФ является одним из самых часто обновляемых веществ. Так у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000-3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ .
Окислительное фосфорилирование -
Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для питания никакой другой субстрат, кроме углеводов.
Предварительно сложные углеводы расщепляются до простых, вплоть до образования глюкозы. Глюкоза является универсальным субстратом в процессе клеточного дыхания. Окисление глюкозы подразделяется на 3 этапа:
1. гликолиз;
2. окислительное декарбоксилирование и цикл Кребса;
3. окислительное фосфорилирование.
При этом гликолиз является общей фазой для аэробного и анаэробного дыхания .
2 .1.1 Гл ико лиз - ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных .
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Гликолиз - один из древнейших метаболических процессов, известный почти у всех живых организмов. Предположительно гликолиз появился более 3,5 млрд. лет назад у первичных прокариот .
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД H.
Полное уравнение гликолиза имеет вид:
С 6 Н 12 О 6 + 2НАД + + 2АДФ + 2Ф н = 2НАД Н + 2ПВК + 2АТФ + 2H 2 O + 2Н + .
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
С 6 Н 12 О 6 + 2АДФ + 2Ф н = 2лактат + 2АТФ + 2H 2 O.
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания - окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, - дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы - глюкозо-6-фосфат (Г-6-Ф ):
Для протекания реакции необходимо наличие в среде ионов Mg 2+ , с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза .
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы - глюкокиназа - имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2 ) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф ):
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3 ) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ ) на две триозы (4 ).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат , причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5 ), который и участвует в дальнейших превращениях:
Каждая молекула глицеральдегидфосфата окисляется НАД + в присутствии дегидрогеназы глицеральдегидфосфата до 1,3- д ифосфоглице - рата (6 ):
Далее с 1,3-дифосфоглицерата , содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7 ) - образуется молекула АТФ:
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3 . Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфо - глицерат (8 ):
Енолаза образует фосфоенолпируват (9 ):
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10 ):
Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10 , в которых и происходит к субстратное фосфорилирование АДФ .
Регуляция гликолиза
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
· активацию гексокиназной реакции;
· стимуляцию фосфофруктокиназы;
· стимуляцию пируваткиназы.
Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоныявляются стимуляторами.
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1 ), фосфофруктокиназой (3 ) и пируваткиназой (10 ) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза .
Гликолиз - катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтезааланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках .
2.1.2 Окислительное декарбоксилирование - окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название "пируватдегидрогеназный комплекс" .
На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E 1). На II стадии оксиэтильная группа комплекса E 1 -ТПФ-СНОН-СН 3 окисляется с образованием ацетильнойгруппы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментомдигидроли-поилацетилтрансферазой (Е 2). Этот фермент катализирует III стадию - перенос ацетильнойгруппы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид-Е 2 . При участии фермента дигидролипоилдегидрогеназы (Е 3) осуществляется переносатомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН 2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н + .
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E 1 , ли-поамид-Е 2 и ФАД-Е 3), а два - легко диссоциируют (HS-KoA и НАД).
Рис. 1 Механизм действия пируватдегидрогеназного комплекса
Е 1 - пируватдегидрогеназа; Е 2 - ди-гидролипоилацетилтрансфсраза; Е 3 - дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.
Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД + + HS-KoA - > Ацетил-КоА + НАДН + Н + + СO 2 .
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.
Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшемуокислению с образованием СО 2 и Н 2 О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбо-ксилирование пирувата, происходит вмитохондриях клеток .
2 .1.3 Цикл трикарбоновых кисло т (цикл Кре бса , цитра тный цикл ) - центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух - и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO 2 . При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии - АТФ.
Цикл Кребса - это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.
Цикл превращения лимонной кислоты в живых клетках был открыт и изучен немецким биохимиком сэром Хансом Кребсом, за эту работу он (совместно с Ф. Липманом) был удостоен Нобелевской премии (1953 год).
У эукариот все реакции цикла Кребса протекают внутри митохондрий, причём катализирующие их ферменты, кроме одного, находятся в свободном состоянии в митохондриальном матриксе, исключение составляет сукцинатдегидрогеназа, которая локализуется на внутренней митохондриальной мембране, встраиваясь в липидный бислой. У прокариот реакции цикла протекают в цитоплазме .
Общее уравнение одного оборота цикла Кребса:
Ацетил-КоА > 2CO 2 + КоА + 8e ?
Регуляция цикл а :
Цикл Кребса регулируется "по механизму отрицательной обратной связи", при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (НАД, ATФ) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются:
· инсулин;
· адреналин.
Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами:
Пируват + СО 2 + АТФ = Оксалоацетат (субстрат Цикла Кребса) + АДФ + Фн.
Работа АТФ-синтазы
Процесс окислительного фосфорилирования осуществляется пятым комплексом дыхательной цепи митохондрий - Протонная АТФ-синтаза, состоящая из 9 субъединиц 5 типов:
· 3 субъединицы (г,д,е) способствуют целостности АТФ-синтазы
· в субъединица является основной функциональной единицей. Она имеет 3 конформации:
· L-конформация - присоединяет АДФ и Фосфат (поступают в митохондрию из цитоплазмы с помощью специальных переносчиков)
· Т-конформация - к АДФ присоединяется фосфат и образуется АТФ
· О-конформация - АТФ отщепляется от в-субъединицы и переходит на б-субъединицу.
· Для того, чтобы субъединица изменила конформацию необходим протон водорода, так как конформация меняется 3 раза необходимо 3 протона водорода. Протоны перекачиваются из межмембранного пространства митохондрии под действием электрохимического потенциала.
· б-субъединица транспортирует АТФ к мембранному переносчику, который "выбрасывает" АТФ в цитоплазму. Взамен из цитоплазмы этот же переносчик транспортирует АДФ. На внутренней мембране митохондрий также находится переносчик Фосфата из цитоплазмы в митохондрию, но для его работы необходим протон водорода. Такие переносчики называются транслоказами .
Суммарный выход
Для синтеза 1 молекулы АТФ необходимо 3 протона.
Ингибиторы окислительного фосфорилирования
Ингибиторы блокируют V комплекс:
· Олигомицин - блокируют протонные каналы АТФ-синтазы.
· Атрактилозид, циклофиллин - блокируют транслоказы.
Разобщители окислительного фосфорилирования
Разобщители - липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс (его протонный канал). Разобщители:
· Естественные - продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
· Искусственные - динитрофенол, эфир, производные витамина К, анестетики .
2.2 Субстратное фосфорилирование
Субстр атное фосфорил ирование (биохимическое), синтез богатых энергией фосфорных соединений за счёт энергии окислительно-восстановительных реакций гликолиза (катализируемых фосфоглице-ральдегиддегидрогеназой и енолазой) и при окислении a-кетоглутаровой кислоты в цикле трикарбоновых кислот (под действием a-кетоглутаратдегидрогеназы и сукцинаттиокиназы). Для бактерий описаны случаи С. ф. при окислении пировиноградной кислоты.С. ф., в отличие от фосфорилирования в цепи переноса электронов, не ингибируется "разобщающими" ядами (например, динитрофенолом) и не связано с фиксацией ферментов в мембранах митохондрий. Вклад С. ф. в клеточный фонд АТФ в аэробных условиях значительно меньше, чем вклад фосфорилирования в цепи переноса электронов .
Глава 3. Пути использования АТФ
3.1 Роль в клетке
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения .
Как известно в биоэнергетике живых организмов имеют значение два основных момента:
а) химическая энергия запасается путём образования АТФ, сопряжённого с экзергоническими катаболическими реакциями окисления органических субстратов;
б) химическая энергия утилизируется путём расщепления АТФ, сопряжённого с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии .
Встаёт вопрос, почему молекула АТФ соответствует своей центральной роли в биоэнергетике. Для его разрешения рассмотрим структуру АТФ Структура АТФ - (при рН 7,0 тетразаряд аниона ) .
АТФ представляет собой термодинамически нестойкое соединение. Нестабильность АТФ определяется, во - первых, электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы, однако сильнее всего связи - Р - О - Р, и во - вторых, конкретным резонансом. В соответствии с последним фактором существует конкуренция между атомами фосфора за неподелённые подвижные электроны атома кислорода, расположенного между ними, поскольку на каждом атоме фосфора имеется частичный положительный заряд в следствии значительного электронаицепторного влияния групп Р=О и Р - О-. Таким образом, возможность существования АТФ определяется наличием достаточного количества химической энергии в молекуле, позволяющей компенсировать эти физико - химические напряжения. В молекуле АТФ имеется две фосфоангидридных (пирофосфатных) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН 7,0 и 37 о С).
АТФ+Н 2 О = АДФ + Н 3 РО 4 G0I = - 31,0 КДж/моль.
АДФ+Н 2 О = АМФ +Н 3 РО 4 G0I = - 31,9 КДж/моль.
Одной из центральных проблем биоэнергетики является биосинтез АТФ, который в живой природе происходит путём Фосфорилирование АДФ.
Фосфорилирование АДФ является эндергоническим процессом и требует источника энергии. Как отмечалось ранее, в природе преобладает два таких источника энергии - это солнечная энергия и химическая энергия восстановленных органических соединений. Зелёные растения и некоторые микроорганизмы способны трансформировать энергию, поглощённых квантов света в химическую энергию, которая расходуется на фосфорилирование АДФ в световой стадии фотосинтеза. Этот процесс регенерации АТФ получил название фотосинтетического фосфорилирования. Трансформация энергии окисления органических соединений в макроэнергетические связи АТФ в аэробных условиях происходит преимущественно путём окислительного фосфорилирования. Свободная энергия, необходимая для образования АТФ, генерируется в дыхательной окислительной цепи митаходрий.
Известен ещё один тип синтеза АТФ, получивший название субстратного фосфорилирования. В отличии от окислительного фосфорилирования, сопряжённого с переносом электронов, донором активированной фосфорильной группой (- РО3 Н2), необходимой для регенерации АТФ, являются интермедианты процессов гликолиза и цикла трикарбоновых кислот. Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений: 1,3 - дифосфоглицерата (гликолиз), сукцинил - КоА (цикл трикарбоновых кислот), которые при участии соответствующих ферментов способны фолирировать АДФ и образовывать АТФ. Трансформация энергии на уровне субстрата является единственным путём синтеза АТФ в анаэробных организмах. Этот процесс синтеза АТФ позволяет поддерживать интенсивную работу скелетных мышц в периоды кислородного голодания. Следует помнить, что он является единственным путём синтеза АТФ в зрелых эритроцитах не имеющих митохондрий.
Особо важную роль в биоэнергетике клетки играет адениловый нуклеотид, и которому присоединены два остатка фосфорной кислоты. Такой вещество называется аденозинтрифосфорной кислотой (АТФ). В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфорита:
АТФ= АДФ+Ф+Е,
где Ф - фермент, Е - освобождающая энергия. В этой реакции образуется аденозинфосфорная кислота (АДФ) - остаток молекулы АТФ и органический фосфат. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производство тепла, нервных импульсов, свечений (например, улюминисцентных бактерий), то есть для всех процессов жизнедеятельности .
АТФ - универсальный биологический аккумулятор энергии. Световая энергия, заключенная в потребляемой пище, запасается в молекулы АТФ.
Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20 - 30 сокращений. При усиленной, но кратковременной работе мышцы работают исключительно за счёт расщепления содержащейся в них АТФ. После окончания работы человек усиленно дышит - в этот период происходит расщепление углеводов и других веществ (происходит накопление энергии) и запас АТФ в клетках восстанавливается.
Также известна роль АТФ в качестве медиатора в синапсах .
3.2 Роль в работе ферментов
Живая клетка является далека от равновесия химическая система: ведь приближение живой системы к равновесию означает ее распад и смерть. Продукт каждого фермента обычно быстро расходуется, поскольку используется в качестве субстрата другим ферментом данного метаболического пути. Еще более важно, что большое количество ферментативных реакций связана с расщеплением АТФ на АДФ и неорганический фосфат. Чтобы это было возможным, пул АТФ в свою очередь должен поддерживаться на уровне, далеком от равновесия, так чтобы отношение концентрации АТФ в концентрации продуктов его гидролиза было высоким. Таким образом, пул АТФ играет роль "аккумулятора", поддерживающий постоянный перенес в клетке энергии и атомов по метаболическим путям, определяются присутствовать ферментами.
Итак, рассмотрим процесс гидролиза АТФ и его влияние на работу ферментов. Представим себе типичный биосинтетических процессов, при котором два мономеры - А и Б - должны объединиться между собой в реакции дегидратации (ее также называют конденсацией), сопровождающееся выделением воды:
А - Н + Б - ОН - АБ + Н2О
Обратная реакция, которую называют гидролизом, в которой молекула воды разрушает ковалентно связанную соединение А - Б, почти всегда будет энергетически выгодной. Это имеет место, например, при гидролитическом расщеплении белков, нуклеиновых кислот и полисахаридов на субъединицы.
Общая стратегия, по которой происходит образование клетки А - Б с А - Н и Б - ОН, включает в себя многоступенчатую последовательность реакций, в результате которых происходит н Связывание энергетически невыгодного синтеза нужных соединений со сбалансированной выгодной реакцией.
Гдролизу АТФ соответствует большая отрицательная величина? G, поэтому гидролиз АТФ часто играет роль энергетически благоприятной реакции, благодаря которой осуществляются внутриклеточные реакции биосинтеза.
На пути от А - Н и Б - ОН-А - Б, связанном с гидролизом АТФ, энергия гидролиза сначала переводит Б - ОН в высокоэнергетическую промежуточную соединение, которое затем непосредственно реагирует с А - Н, образуя А - Б. простой механизм данного процесса включает в себя перенес фосфата от АТФ к Б - ОН с образованием Б - ОРО 3 , или Б - О - Р, причем в этом случае суммарная реакция происходит лишь в две стадии:
1) Б - ОН + АТФ - Б - В - Р + АДФ
2) А - Н + Б - О - Р - А - Б + Р
Поскольку промежуточное соединение Б - О - Р, образующегося в процессе реакции, вновь разрушается, суммарные реакции можно описать с помощью следующих уравнений:
3) А-Н + Б - ОН - А - Б и АТФ - АДФ + Р
Первая, энергетически невыгодна реакция, оказывается возможной потому, что она связана со второй, энергетически выгодной реакцией (гидролиз АТФ). Примером связанных биосинтетических реакций подобного типа может быть синтез аминокислоты глутамина.
Величина G гидролиза АТФ до АДФ и неорганического фосфата зависит от концентрации всех реагирующих веществ и обычно для клетки условиях лежит в пределах от - 11 до - 13 ккал / моль. Реакция гидролиза АТФ, наконец, может быть использована для осуществления термодинамически невыгодной реакции со значением G, равным примерно +10 ккал / моль, конечно, в присутствии соответствующей последовательности реакций. Однако для многих реакций биосинтеза оказывается недостаточным даже? G = - 13 ккал / моль. В этих и других случаях путь гидролиза АТФ изменяется таким образом, что сначала образуются АМФ и РР (пирофосфат). На следующей стадии пирофосфат также подвергается гидролизу; общее изменение свободной энергии всего процесса составляет примерно - 26 ккал / моль.
Каким образом энергия гидролиза пирофосфата используется в биосинтетических реакциях? Один из путей можно продемонстрировать на примере приведенного выше синтеза соединения А - Б с А - Н и Б - ОН. При помощи соответствующего фермента Б - ОН может вступить в реакцию с АТФ и превратиться в высокоэнергетическую соединение Б - О - Р - Р. Теперь реакция состоит из трех стадий:
1) Б - ОН + АТФ - Б - В - Р - Р + АМФ
2) А - Н + Б - О - Р - Р - А - Б + РР
3) РР + Н2О - 2Р
Суммарную реакцию можно представить в следующем виде:
А - Н + Б - ОН - А - Б и АТФ + Н2О - АМФ + 2Р
Поскольку фермент всегда ускоряет катализовану ним реакцию как в прямом, так и в обратном направлении, соединение А - Б может распадаться, реагируя с пирофосфатом (реакция, обратная стадии 2). Однако энергетически выгодная реакция гидролиза пирофосфата (стадия 3) способствует поддержанию стабильности соединения А-Б за счет того, что концентрация пирофосфата остается очень низкой (это предотвращает протекание реакции, обратной к стадии 2). Таким образом, энергия гидролиза пирофосфата обеспечивает протекание реакции в прямом направлении. Примером важной биосинтетических реакции такого типа является синтез полинуклеотидов .
3.3 Роль в синтезе ДНК и РНК и белков
Во всех известных организмах, дезоксирибонуклеотиды, которые составляют ДНК синтезируется под действием ферментов рибонуклеотид-редуктазы (РНР) на соответствующих рибонуклеотидах. Эти ферменты снижают остатка сахара отрибозы, чтобы дезоксирибоза путем удаления кислорода из 2" гидроксильные группы, субстраты рибонуклеозид дифосфаты и продукты дезоксирибонуклеозид дифосфаты. Все ферменты редуктазы использоют общие сульфгидрильные радикального механизма зависит от реактивного цистеина остатков, которые окисляются с образованием дисульфидных связей в ход реакции. РНР фермент перерабатывается в результате реакции с тиоредоксином или глутаредоксином.
Регулирование РНР и связанных с ними ферментов, поддерживает баланс по отношению друг к другу. Очень низкая концентрация подавляет синтез ДНК и репарацию ДНК и является летальным для клетки, в то время как ненормальные отношения является мутагенным в связи с увеличением вероятности ДНК-полимеразы включения в процессе синтеза ДНК.
При синтезе нуклеиновых кислот РНК, аденозина, полученных от АТФ является одним из четырех нуклеотидов включены непосредственно в молекулах РНК, РНК-полимеразы. Энергия, это полимеризация происходит с отщеплением пирофосфата (две фосфатные группы). Этот процесс аналогичен в биосинтезе ДНК, за исключением того, что АТФ сводится к дезоксирибонуклеотиду дАТФ, перед включением в ДНК .
В синтезе белка . Аминоацил-тРНК-синтетазы используют ферменты АТФ в качестве источника нергии для прикрепления молекулы тРНК к его конкретной аминокислоте, образующей аминоацил-тРНК, готовый к переводом на рибосомы. Энергия становится доступной в результате гидролиза АТФ аденозинмонофосфата (AMФ) удаляют две фосфатные группы.
АТФ используется для многих клеточных функций, включая транспортную работу перемещения веществ через клеточные мембраны. Он также используется для механической работы, поставка энергии, необходимой для мышечного сокращения. Она поставляет энергию не только в сердечной мышце (для циркуляции крови) и скелетных мышц (например, за грубое движение тела), но также и к хромосомам и жгутиков, чтобы они могли выполнять свои многочисленные функции. Большую роль АТФ в химической работе, предоставлению необходимой энергии для синтеза нескольких тысяч типов макромолекул, что клетка должна существовать.
АТФ также используется в качестве включения-выключения как для контроля химических реакций и для отправки информации. Форма белковых цепей, которые производят строительные блоки и другие структуры, используемые в жизни определяется в основном слабые химические связи, которые легко исчезают и переструктурируются. Эти цепи могут сократить, удлинить, а также изменить форму в ответ на ввод или вывод энергии. Изменения в цепях изменить форму белка, а также может изменять свои функции или вызвать его, чтобы стать активным или неактивным.
Молекулы АТФ могут связываться в одной части молекулы белка, в результате чего другая часть той же молекулы, чтобы скользить или слегка двигаться который заставляет его изменять свою конформацию, инактивации молекул. После удаления АТФ вызывает белок, чтобы вернуться к своей первоначальной форме, и таким образом она снова функциональным.
Цикл может повторятся до тех пор, пока молекула возвращается, эффективно действующая в качестве и выключателя и переключателя. Оба добавлением фосфора (фосфорилирование) и удаления фосфора из белка (дефосфорилирование) может служить либо включения или выключения .
3.4 Другие функции АТФ
Роль в метаболизме, синтезе и активном транспорте
Таким образом, АТФ передает энергию между пространственно разделенных метаболических реакций. АТФ является основным источником энергии для большинства клеточных функций. Это включает в себя синтез макромолекул, включая ДНК и РНК, и белки. АТФ также играет важную роль в транспорте макромолекул через клеточные мембраны, например, экзоцитоза и эндоцитоза.
Роль в структуре клеток и передвижения
ATФ участвует в поддержании клеточной структуры путем облегчения монтажа и демонтажа элементов цитоскелета. В связи с этим процессом, АТФ, необходимых для сокращения нитей актина и миозина необходимых для мышечного сокращения. Этот последний процесс является одним из основных требований энергию животных и имеет важное значение для движения и дыхания.
Роль в сигнальных системах
Во внеклеточных сигнальных системах
АТФ также является сигнальной молекулой. АТФ, АДФ, или аденозин признаны пуринергическими рецепторов. Пуринорецепторы могут быть наиболее распространенных рецепторов в тканях млекопитающих.
У людей этой сигнализации роль важна как в центральной и периферической нервной системы. Активность зависит от выпуска АТФ из синапсов, аксонов и глии пуринергическими активирует рецепторы мембраны
Во внутриклеточных сигнальных системах
АТФ имеет решающее значение в передаче сигнала процессов. Он используется киназ в качестве источника фосфатных групп в их реакции фосфата передачи. Киназы на подложках, таких как белки или липиды мембраны являются распространенной формой сигнала. Фосфорилирование белка по киназе могут активировать этот каскад, такие как митогенактивированной протеинкиназыкаскада.
АТФ используется также аденилатциклазу и превращается в вторичный мессенджер молекулы АМФ, который участвует в запуске кальция сигналы высвобождение кальция из внутриклеточных депо. [ 38 ] Эта форма сигнала имеет особенно важное значение в функции мозга, хотя он участвует в регуляции множества других клеточных процессов .
Заключение
1. Аденозинтрифосфат - нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы. По строению АТФ сходна с адениновым нуклеотидом, входящим в состав РНК, только вместо одной фосфорной кислоты в состав АТФ входят три остатка фосфорной кислоты. Клетки не в состоянии содержать кислоты в заметных количествах, а только их соли. Поэтому фосфорная кислота входит в АТФ в виде остатка (вместо ОН-группы кислоты имеется отрицательно заряженный атом кислорода).
2. В организме АТФ синтезируется путём фосфорилирования АДФ:
АДФ + H 3 PO 4 + энергия > АТФ + H 2 O.
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование (используя энергию окисляющихся веществ).
Окислительное фосфорилирование - один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений - белки, жиры и углеводы. Процесс окислительного фосфорилирования проходит на кристах митохондрий.
Субстр атное фосфорил ирование (биохимическое), синтез богатых энергией фосфорных соединений за счёт энергии окислительно-восстановительных реакций гликолиза и при окислении a-кетоглутаровой кислоты в цикле трикарбоновых кислот.
3. Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. В биоэнергетике живых организмов имеют значение: химическая энергия запасается путём образования АТФ, сопряжённого с экзергоническими катаболическими реакциями окисления органических субстратов; химическая энергия утилизируется путём расщепления АТФ, сопряжённого с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии.
4. При усиленной нагрузке (например, в беге на короткие дистанции) мышцы работают исключительно за счет запаса АТФ. В клетках мышц этого запаса хватает на несколько десятков сокращений, а дальше количество АТФ должно восполняться. Синтез АТФ из АДФ и АМФ происходит за счет энергии, выделяющейся при расщеплении углеводов, липидов и других веществ. На выполнение умственной работы также затрачивается большое количество АТФ. По этой причине людям умственного труда требуется повышенное количество глюкозы, расщепление которой обеспечивает синтез АТФ.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
· Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
· Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
· АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата - вторичного посредника передачи в клетку гормонального сигнала.
Также известна роль АТФ в качестве медиатора в синапсах.
Библиографический список
1. Лемеза, Н.А. Пособие по биологии для поступающих в ВУЗы / Л.В. Камлюк Н.Д. Лисов. - Мн.: Юнипресс, 2011 г. - 624 с.
2. Lodish, H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky SL, Darnell J. Molecular Cell Biology, 5th ed. - New York: WH Freeman, 2004.
3. Романовский, Ю.М. Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза - вращающийся молекулярный мотор / Ю.М. Романовский А.Н. Тихонов // УФН. - 2010. - Т.180. - С.931 - 956.
4. Voet D, Voet JG. Biochemistry Vol 1 3rd ed. - Wiley: Hoboken, NJ. - N-Y: W. H. Freeman and Company, 2002. - 487 р.
5. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: Высшая школа, 1993 г
6. Вершубский, А.В. Биофизика. / А.В. Вершубский, В.И. Прик-лонский, А.Н. Тихонов. - М: 471-481.
7. Альбертс Б. Молекулярная биология клетки в 3-х томах. / Альбертс Б., Брей Д., Льюис Дж. и др. М.: Мир, 1994.1558 с.
8. Николаев А.Я. Биологическая химия - М.: ООО "Медицинское информационное агенство", 1998.
9. Berg, J. M. Biochemistry, international edition. / Berg, J. M, Tymoczko, J. L, Stryer, L. - New York: WH Freeman, 2011; p 287.
10. Кнорре Д.Г. Биологическая химия: Учеб. для хим., биол. И мед. спец. вузов. - 3-е изд., испр. / Кнорре Д.Г., Мысина С.Д. - М.: Высш. шк., 2000. - 479 с.: ил.
11. Элиот, В. Биохимия и молекулярная биология / В. Элиот, Д. Элиот. - М.: Изд-во НИИ Биомедицинской химии РАМН, ООО "Материк-альфа", 1999, - 372 с.
12. Shina CL, K., 7 Areieh, W. On the Energetics of ATP Hydrolysis in Solution. Journal Of Physical Chemistry B,113 (47), (2009).
13. Berg, J. M. Biochemistry / J. M. Berg: J. L. Tymoczko, L. Stryer. - N-Y: W. H. Freeman and Company, 2002. - 1514 p.
...Подобные документы
Органические соединения в организме человека. Строение, функции и классификация белков. Нуклеиновые кислоты (полинуклеотиды), особенности строений и свойства РНК н ДНК. Углеводы в природе и организме человека. Липиды - жиры и жироподобные вещества.
реферат , добавлен 06.09.2009
Процесс синтеза белков и их роль в жизнедеятельности живых организмов. Функции и химические свойства аминокислот. Причины их нехватки в организме человека. Виды продуктов, в которых содержатся незаменимые кислоты. Аминокислоты, синтезируемые в печени.
презентация , добавлен 23.10.2014
Энергетическая, запасающая и опорно-строительная функции углеводов. Свойства моносахаридов как основного источника энергии в организме человека; глюкоза. Основные представители дисахаридов; сахароза. Полисахариды, образование крахмала, углеводный обмен.
доклад , добавлен 30.04.2010
Функции обмена веществ в организме: обеспечение органов и систем энергией, вырабатываемой при расщеплении пищевых веществ; превращение молекул пищевых продуктов в строительные блоки; образование нуклеиновых кислот, липидов, углеводов и других компонентов.
реферат , добавлен 20.01.2009
Роль и значение белков, жиров и углеводов для нормального протекания всех жизненно важных процессов. Состав, структура и ключевые свойства белков, жиров и углеводов, их важнейшие задачи и функции в организме. Основные источники данных пищевых веществ.
презентация , добавлен 11.04.2013
Характеристика структуры холестериновых молекул как важного компонента клеточной мембраны. Исследование механизмов регуляции обмена холестерина в организме человека. Анализ особенностей возникновения избытка липопротеидов низкой плотности в кровотоке.
реферат , добавлен 17.06.2012
Обмен белков, липидов и углеводов. Типы питания человека: всеядность, раздельное и низкоуглеводное питание, вегетарианство, сыроедение. Роль белков в обмене веществ. Недостаток жиров в организме. Изменения в организме в результате изменения типа питания.
курсовая работа , добавлен 02.02.2014
Рассмотрение участия железа в окислительных процессах и в синтезе коллагена. Ознакомление со значением гемоглобина в процессах кровообразования. Головокружения, одышка и нарушение обмена веществ как результат дефицита железа в человеческом организме.
презентация , добавлен 08.02.2012
Свойства фтора и железа. Суточная потребность организма. Функции фтора в организме, влияние, смертельная доза, взаимодействие с другими веществами. Железо в организме человека, его источники. Последствия дефицита железа для организма и его переизбытка.
презентация , добавлен 14.02.2017
Белки как источники питания, их основные функции. Аминокислоты, участвующие в создании белков. Строение полипептидной цепи. Превращения белков в организме. Полноценные и неполноценные белки. Структура белка, химические свойства, качественные реакции.
text_fields
text_fields
arrow_upward
Извлечение энергии из питательных веществ - углеводов, белков, жиров происходит, в основном, внутри клетки. В ней все углеводы представлены глюкозой, белки - аминокислотами, жиры - жирными кислотами. В клетке глюкоза под влиянием энзимов цитоплазмы превращается в пировиноградную кислоту (в ходе анаэробного гликолиза) (рис. 1.6).
Рис. 1.6 Образование АТФ при полном окислении глюкозы
В ходе этих превращений из одной молекулы глюкозы образуется 2 молекулы АТФ (не считая 2 молекул АТФ, фосфорилирующих субстрат). Превращение пирувата в 2 молекулы ацетилкоэнзима А (АцКоА) способствует образованию еще 6 молекул АТФ. И, наконец, АцКоА поступает в митохондрии и, окисляясь в них до СО 2 и Н 2 О, образует еще 24 молекулы АТФ. Но не только пировиноградная кислота, а и жирные кислоты и большинство аминокислот превращаются в цитоплазме в АцКоА и также поступают в матрике митохондрий. В цикле Кребса АцКоА расщепляется до атомов водорода и окиси углерода. Окись углерода диффундирует из митохондрий, и далее из клетки. Атомы водорода соединяются с окисленным никотинамидадениндинуклеотидом (НАД+), формируя восстановленный НАД (НАДН), и с окисленным никотинамидаде-ниндинуклеотид фосфатом (НАДФ), формируя восстановленный НАДФН, а затем переносятся молекулами - переносчиками водорода от НАДН и НАДФН на систему ферментов внутренней митохондриальной мембраны.
В результате НАДН и НАДФН отдают один протон и два электрона в электротранспортную цепь, образуемую этими ферментами (рис.1.7).
 Рис.1.7 Взаимоотношения расщепления пищевых веществ и электрон-транспортной системы в клетке
Рис.1.7 Взаимоотношения расщепления пищевых веществ и электрон-транспортной системы в клетке
В ходе передачи электронов в цепи переносчиков возрастают окислительно-восстановительные потенциалы - от отрицательных значений до потенциала восстановления О 2 . Эта разница окислительно-восстановительных потенциалов и образует ту движущую силу, которая приводит к синтезу АТФ. Описанный перенос электронов и протонов от НАДН и НАДФН по цепи транспорта электронов называется окислительным фосфорилированием. Согласно хемиосмотической теории, объясняющей механизм образования энергии при окислительном фосфорилировании, в ходе передачи электронов по электронно-транспортной цепи, пара электронов три раза пересекает внутреннюю мембрану митохондрий, каждый раз перенося два протона наружу (рис. 1.8).
Рис. 1.8 Хемиосмотический механизм окислительного фосфорилирования во внутренней мембране митоходрий.В результате возникает высокая концентрация протонов снаружи мембраны, и низкая - в матриксе митохондрий и, как следствие, разница в электрическом потенциале между наружным (имеющим положительный заряд) и внутренним (накапливающим отрицательный заряд) слоем мембраны. Оба эти фактора (электрическое поле и разность концентраций) формируют электрохимический трансмембранный протонный градиент, благодаря которому протоны начинают возвращаться назад через мембрану. Это обратное движение протонов осуществляется через мембранный белок, к которому присоединяется АТФ-синтетаза, расположенная на внутренней (матричной) стороне мембраны. Взаимодействие мембранного белка с АТФ-синтетазой активирует ее и сопровождается синтезом АТФ из аденозин-дифосфорной (АДФ) и фосфорной кислот (Фн). Следовательно, поток протонов через мембрану активирует реакцию:
АДФ + Фн —> АТФ + Н 2 О
Энергия протонного градиента также обеспечивает транспорт ионов кальция и натрия через мембрану митохондрий, восстановление в них НАДФ+ с помощью НАДН, образование тепла. Молекулы АТФ, образовавшиеся в ходе гликолиза и окислительного фосфорилирования используются клеткой для обеспечения энергией почти всех внутриклеточных метаболических реакций.
Рис. 1.9 Схема молекулы АТФ. Стрелками показаны Тpuфocфam Высокоэнергетические связи.Макроэргические фосфатные связи молекулы АТФ очень нестойки и концевые фосфатные группы легко отщепляются от АТФ, освобождая энергию (7-10 ккал/моль АТФ) (рис. 1.9).
Энергия передается переносом отщепившихся, богатых энергией фосфатных групп на различные субстраты, ферменты, активируя их, расходуется на мышечное сокращение и т.п.
Энергетическая фосфогенная система
text_fields
text_fields
arrow_upward
Энергия макроэргических связей молекулы АТФ является универсальной формой запаса свободной энергии в организме. Вместе с тем, количество АТФ, хранимое внутри клетки невелико. Оно обеспечивает ее работу лишь в течение нескольких секунд. Это обстоятельство привело к формированию чувствительных механизмов, регулирующих энергетический обмен в скелетной, сердечной и нервных клетках. В этих тканях присутствуют органические фосфатные соединения, накапливающие энергию в форме фосфатных связей и представляющие собой источник этих богатых энергией фосфатных групп для синтеза АТФ. Органические фосфатные соединения получили название фосфагенов. Наиболее важным из них у человека является креатинфосфат (КФ). При его расщеплении высвобождается энергия до 10 ккал/моль, используемая для ресинтеза АТФ. Снижение содержания АТФ в этих тканях ведет к распаду КФ, а увеличение концентрации АТФ - к его ресинтезу. Так, в скелетной мышце концентрация КФ в 3-5 раз больше, чем АТФ. Гидролиз КФ (на креатин и фосфат) под влиянием фермента креатинкиназы обеспечивает ресинтез АТФ, являющейся источником энергии для мышечного сокращения:
Освободившийся креатин вновь используется клеткой для аккумуляции энергии в креатинфосфате. Этот эффект сохраняет концентрацию АТФ в клетке на относительно постоянном уровне. Поэтому фосфокреатин клеток скелетной мышцы и ее АТФ составляют, так называемую, энергетическую фосфогенную систему. Энергия фосфогенной системы используется для обеспечения «рывковой» мышечной активности, продолжительностью до 10-15 секунд, т.е. максимальной мышечной мощности, достаточной для бега на 100-метровую дистанцию.
Энергообеспечивающая система "гликоген-молочная кислота"
text_fields
text_fields
arrow_upward
Продолжающаяся более 10-15 секунд мышечная работа на максимально высоком уровне в следующие 30-40 секунд обеспечивается энергией анаэробного гликолиза, т.е. превращением молекулы глюкозы из расщепляющегося углеводного депо - гликогена печени и мышц до молочной кислоты. При анаэробном гликолизе молекулы АТФ образуются почти в 2,5 раза быстрее, чем при аэробном окислении в митохондриях. Таким образом, фосфогенная система и анаэробное расщепление гликогена до молочной кислоты (система гликоген - молочная кислота) обеспечивают человеку возможность мышечной рывковой работы значительного объема (в спорте - бег на короткие дистанции, подъем тяжестей, ныряние и т.д.) Более продолжительная мышечная работа человека требует усиления окислительного фосфорилирования в митохондриях, обеспечивающего, как было показано выше, основную часть ресинтеза АТФ.
Продолжение. См. № 11, 12, 13, 14, 15, 16/2005
Уроки биологии в классах естественно-научного профиля
Расширенное планирование, 10 класс
Урок 19. Химическое строение и биологическая роль АТФ
Оборудование: таблицы по общей биологии, схема строения молекулы АТФ, схема взаимосвязи пластического и энергетического обменов.
I. Проверка знаний
Проведение биологического диктанта «Органические соединения живой материи»
Учитель читает тезисы под номерами, учащиеся записывают в тетрадь номера тех тезисов, которые подходят по содержанию их варианту.
Вариант 1 – белки.
Вариант 2 – углеводы.
Вариант 3 – липиды.
Вариант 4 – нуклеиновые кислоты.
1. В чистом виде состоят только из атомов С, Н, О.
2. Кроме атомов С, Н, О содержат атомы N и обычно S.
3. Кроме атомов С, Н, О содержат атомы N и Р.
4. Обладают относительно небольшой молекулярной массой.
5. Молекулярная масса может быть от тысяч до нескольких десятков и сотен тысяч дальтон.
6. Наиболее крупные органические соединения с молекулярной массой до нескольких десятков и сотен миллионов дальтон.
7. Обладают различными молекулярными массами – от очень небольшой до весьма высокой, в зависимости от того, является ли вещество мономером или полимером.
8. Состоят из моносахаридов.
9. Состоят из аминокислот.
10. Состоят из нуклеотидов.
11. Являются сложными эфирами высших жирных кислот.
12. Основная структурная единица: «азотистое основание–пентоза–остаток фосфорной кислоты».
13. Основная структурная единица: «аминокислот».
14. Основная структурная единица: «моносахарид».
15. Основная структурная единица: «глицерин–жирная кислота».
16. Молекулы полимеров построены из одинаковых мономеров.
17. Молекулы полимеров построены из сходных, но не вполне одинаковых мономеров.
18. Не являются полимерами.
19. Выполняют почти исключительно энергетическую, строительную и запасающую функции, в некоторых случаях – защитную.
20. Помимо энергетической и строительной выполняют каталитическую, сигнальную, транспортную, двигательную и защитную функции;
21. Осуществляют хранение и передачу наследственных свойств клетки и организма.
Вариант 1
– 2; 5; 9; 13; 17; 20.
Вариант 2
– 1; 7; 8; 14; 16; 19.
Вариант 3
– 1; 4; 11; 15; 18; 19.
Вариант 4
– 3; 6; 10; 12; 17; 21.
II. Изучение нового материала
1. Строение аденозинтрифосфорной кислоты
Кроме белков, нуклеиновых кислот, жиров и углеводов в живом веществе синтезируется большое количество других органических соединений. Среди них важнуую роль в биоэнергетике клетки играет аденозинтрифосфорная кислота (АТФ). АТФ содержится во всех клетках растений и животных. В клетках чаще всего аденозинтрифосфорная кислота присутствует в виде солей, называемых аденозинтрифосфатами . Количество АТФ колеблется и в среднем составляет 0,04% (в клетке в среднем находится около 1 млрд молекул АТФ). Наибольшее количество АТФ содержится в скелетных мышцах (0,2–0,5%).
Молекула АТФ состоит из азотистого основания – аденина, пентозы – рибозы и трех остатков фосфорной кислоты, т.е. АТФ – особый адениловый нуклеотид. В отличие от других нуклеотидов АТФ содержит не один, а три остатка фосфорной кислоты. АТФ относится к макроэргическим веществам – веществам, содержащим в своих связях большое количество энергии.
Пространственная модель (А) и структурная формула (Б) молекулы АТФ
Из состава АТФ под действием ферментов АТФаз отщепляется остаток фосфорной кислоты. АТФ имеет устойчивую тенденцию к отделению своей концевой фосфатной группы:
АТФ 4– + Н 2 О ––> АДФ 3– + 30,5 кДж + Фн,
т.к. это приводит к исчезновению энергетически невыгодного электростатического отталкивания между соседними отрицательными зарядами. Образовавшийся фосфат стабилизируется за счет образования энергетически выгодных водородных связей с водой. Распределение заряда в системе АДФ + Фн становится более устойчивым, чем в АТФ. В результате этой реакции высвобождается 30,5 кДж (при разрыве обычной ковалентной связи высвобождается 12 кДж).
Для того, чтобы подчеркнуть высокую энергетическую «стоимость» фосфорно-кислородной связи в АТФ, ее принято обозначать знаком ~ и называть макроэнергетической связью. При отщеплении одной молекулы фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорная кислота), а если отщепляются две молекулы фосфорной кислоты, то АТФ переходит в АМФ (аденозинмонофосфорная кислота). Отщепление третьего фосфата сопровождается выделением всего 13,8 кДж, так что собственно макроэргических связей в молекуле АТФ только две.
2. Образование АТФ в клетке
Запас АТФ в клетке невелик. Например, в мышце запасов АТФ хватает на 20–30 сокращений. Но ведь мышца способна работать часами и производить тысячи сокращений. Поэтому наряду с распадом АТФ до АДФ в клетке должен непрерывно идти обратный синтез. Существует несколько путей синтеза АТФ в клетках. Познакомимся с ними.
1. Анаэробное фосфорилирование. Фосфорилированием называют процесс синтеза АТФ из АДФ и низкомолекулярного фосфата (Фн). В данном случае речь идет о бескислородных процессах окисления органических веществ (например, гликолиз – процесс бескислородного окисления глюкозы до пировиноградной кислоты). Примерно 40% выделяемой в ходе этих процессов энергии (около 200 кДж/моль глюкозы), расходуется на синтез АТФ, а остальная часть рассеивается в виде тепла:
С 6 Н 12 О 6 + 2АДФ + 2Фн ––> 2С 3 Н 4 O 3 + 2АТФ + 4Н.
2. Окислительное фосфорилирование – это процесс синтеза АТФ за счет энергии окисления органических веществ кислородом. Этот процесс был открыт в начале 1930-х гг. XX в. В.А. Энгельгардтом. Кислородные процессы окисления органических веществ протекают в митохондриях. Примерно 55% выделяющейся при этом энергии (около 2600 кДж/моль глюкозы) превращается в энергию химических связей АТФ, а 45% рассеивается в виде тепла.
Окислительное фосфорилирование значительно эффективнее анаэробных синтезов: если в процессе гликолиза при распаде молекулы глюкозы синтезируется всего 2 молекулы АТФ, то в ходе окислительного фосфорилирования образуется 36 молекул АТФ.
3. Фотофосфорилирование – процесс синтеза АТФ за счет энергии солнечного света. Этот путь синтеза АТФ характерен только для клеток, способных к фотосинтезу (зеленые растения, цианобактерии). Энергия квантов солнечного света используется фотосинтетиками в световую фазу фотосинтеза для синтеза АТФ.
3. Биологическое значение АТФ
АТФ находится в центре обменных процессов в клетке, являясь связующим звеном между реакциями биологического синтеза и распада. Роль АТФ в клетке можно сравнить с ролью аккумулятора, так как в ходе гидролиза АТФ выделяется энергия, необходимая для различных процессов жизнедеятельности («разрядка»), а в процессе фосфорилирования («зарядка») АТФ вновь аккумулирует в себе энергию.

За счет выделяющейся при гидролизе АТФ энергии происходят почти все процессы жизнедеятельности в клетке и организме: передача нервных импульсов, биосинтез веществ, мышечные сокращения, транспорт веществ и др.
III. Закрепление знаний
Решение биологических задач
Задача 1. При быстром беге мы часто дышим, происходит усиленное потоотделение. Объясните эти явления.
Задача 2. Почему на морозе замерзающие люди начинают притопывать и подпрыгивать?
Задача 3. В известном произведении И.Ильфа и Е.Петрова «Двенадцать стульев» среди многих полезных советов можно найти и такой: «Дышите глубже, вы взволнованы». Попробуйте обосновать этот совет с точки зрения происходящих в организме энергетических процессов.
IV. Домашнее задание
Начать подготовку к зачету и контрольной работе (продиктовать вопросы зачета – см. урок 21).
Урок 20. Обобщение знаний по разделу «Химическая организация жизни»
Оборудование: таблицы по общей биологии.
I. Обобщение знаний раздела
Работа учащихся с вопросами (индивидуально) с последующими проверкой и обсуждением
1. Приведите примеры органических соединений, в состав которых входят углерод, сера, фосфор, азот, железо, марганец.
2. Как по ионному составу можно отличить живую клетку от мертвой?
3. Какие вещества находятся в клетке в нерастворенном виде? В какие органы и ткани они входят?
4. Приведите примеры макроэлементов, входящих в активные центры ферментов.
5. Какие гормоны содержат микроэлементы?
6. Какова роль галогенов в организме человека?
7. Чем белки отличаются от искусственных полимеров?
8. Чем отличаются пептиды от белков?
9. Как называется белок, входящий в состав гемоглобина? Из скольких субъединиц он состоит?
10. Что такое рибонуклеаза? Сколько аминокислот входит в ее состав? Когда она была синтезирована искусственно?
11. Почему скорость химических реакций без ферментов мала?
12. Какие вещества транспортируются белками через клеточную мембрану?
13. Чем отличаются антитела от антигенов? Содержат ли вакцины антитела?
14. На какие вещества распадаются белки в организме? Сколько энергии выделяется при этом? Где и как обезвреживается аммиак?
15. Приведите пример пептидных гормонов: как они участвуют в регуляции клеточного метаболизма?
16. Какова структура сахара, с которым мы пьем чай? Какие еще три синонима этого вещества вы знаете?
17. Почему жир в молоке не собирается на поверхности, а находится в виде суспензии?
18. Какова масса ДНК в ядре соматической и половой клеток?
19. Какое количество АТФ используется человеком в сутки?
20. Из каких белков люди изготавливают одежду?

Первичная структура панкреатической рибонуклеазы (124 аминокислоты)
II. Домашнее задание.
Продолжить подготовку к зачету и контрольной работе по разделу «Химическая организация жизни».
Урок 21. Зачетный урок по разделу «Химическая организация жизни»
I. Проведение устного зачета по вопросам
1. Элементарный состав клетки.
2. Характеристика органогенных элементов.
3. Структура молекулы воды. Водородная связь и ее значение в «химии» жизни.
4. Свойства и биологические функции воды.
5. Гидрофильные и гидрофобные вещества.
6. Катионы и их биологическое значение.
7. Анионы и их биологическое значение.
8. Полимеры. Биологические полимеры. Отличия периодических и непериодических полимеров.
9. Свойства липидов, их биологические функции.
10. Группы углеводов, выделяемые по особенностям строения.
11. Биологические функции углеводов.
12. Элементарный состав белков. Аминокислоты. Образование пептидов.
13. Первичная, вторичная, третичная и четвертичная структуры белков.
14. Биологические функция белков.
15. Отличия ферментов от небиологических катализаторов.
16. Строение ферментов. Коферменты.
17. Механизм действия ферментов.
18. Нуклеиновые кислоты. Нуклеотиды и их строение. Образование полинуклеотидов.
19. Правила Э.Чаргаффа. Принцип комплементарности.
20. Образование двухцепочечной молекулы ДНК и ее спирализация.
21. Классы клеточной РНК и их функции.
22. Отличия ДНК и РНК.
23. Репликация ДНК. Транскрипция.
24. Строение и биологическая роль АТФ.
25. Образование АТФ в клетке.
II. Домашнее задание
Продолжить подготовку к контрольной работе по разделу «Химическая организация жизни».
Урок 22. Контрольный урок по разделу «Химическая организация жизни»
I. Проведение письменной контрольной работы
Вариант 1
1. Имеются три вида аминокислот – А, В, С. Сколько вариантов полипептидных цепей, состоящих из пяти аминокислот, можно построить. Укажите эти варианты. Будут ли эти полипептиды обладать одинаковыми свойствами? Почему?
2. Все живое в основном состоит из соединений углерода, а аналог углерода – кремний, содержание которого в земной коре в 300 раз больше, чем углерода, встречается лишь в очень немногих организмах. Объясните этот факт с точки зрения строения и свойств атомов этих элементов.
3. В одну клетку ввели молекулы АТФ, меченные радиоактивным 32Р по последнему, третьему остатку фосфорной кислоты, а в другую – молекулы АТФ, меченные 32Р по первому, ближайшему к рибозе остатку. Через 5 минут в обеих клетках померили содержание неорганического фосфат-иона, меченного 32Р. Где оно окажется значительно выше?
4. Исследования показали, что 34% общего числа нуклеотидов данной иРНК приходится на гуанин, 18% – на урацил, 28% – на цитозин и 20% – на аденин. Определите процентный состав азотистых оснований двухцепочечной ДНК, слепком с которой является указанная иРНК.
Вариант 2
1. Жиры составляют «первый резерв» в энергетическом обмене и используются, когда исчерпан резерв углеводов. Однако в скелетных мышцах при наличии глюкозы и жирных кислот в большей степени используются последние. Белки же в качестве источника энергии всегда используются лишь в крайнем случае, при голодании организма. Объясните эти факты.
2. Ионы тяжелых металлов (ртути, свинца и др.) и мышьяка легко связываются сульфидными группировками белков. Зная свойства сульфидов этих металлов, объясните, что произойдет с белком при соединении с этими металлами. Почему тяжелые металлы являются ядами для организма?
3. В реакции окисления вещества А в вещество В освобождается 60 кДж энергии. Сколько молекул АТФ может быть максимально синтезировано в этой реакции? Как будет израсходована остальная энергия?
4. Исследования показали, что 27% общего числа нуклеотидов данной иРНК приходится на гуанин, 15% – на урацил, 18% – на цитозин и 40% – на аденин. Определите процентный состав азотистых оснований двухцепочечной ДНК, слепком с которой является указанная иРНК.
Продолжение следует